Jacob Hoover
0
1714
195
Los anticuerpos son proteínas especializadas en forma de Y que se unen como un candado y una llave a los invasores extraños del cuerpo, ya sean virus, bacterias, hongos o parásitos. Son el batallón de "búsqueda" del sistema de búsqueda y destrucción del sistema inmunológico, encargado de encontrar un enemigo y marcarlo para su destrucción..
"Los liberan de la celda y salen a cazar", dijo el Dr. Warner Greene, director del Centro de Investigación para la Curación del VIH de los Institutos Gladstone en San Francisco..
Cuando los anticuerpos encuentran su objetivo, se unen a él, lo que desencadena una cascada de acciones que derrotan al invasor. Los anticuerpos son parte del llamado sistema inmunológico "adaptativo", el brazo del sistema inmunológico que aprende a reconocer y eliminar patógenos específicos, dijo Greene..
Relacionado: Diagrama del sistema inmunológico humano (infografía)
¿Cómo se ven los anticuerpos??
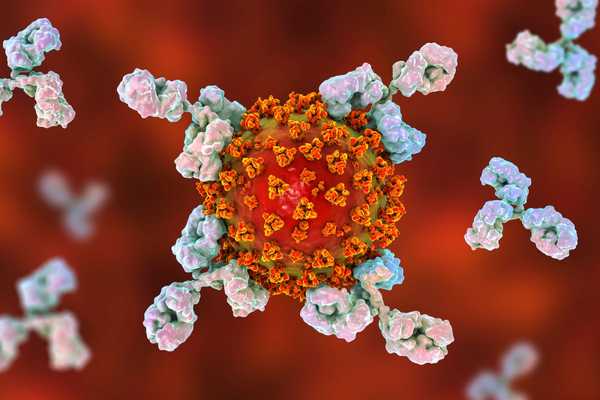
Los dos brazos en la parte superior de la forma de Y del anticuerpo se unen a lo que se conoce como antígeno. El antígeno puede ser una molécula o un fragmento molecular, a menudo una parte de un virus o una bacteria. (Por ejemplo, el nuevo coronavirus SARS-CoV-2 tiene "picos" únicos en su capa exterior, y algunos anticuerpos se unen y reconocen estas proteínas de picos).
La parte inferior de la Y, o el tallo, se une a varios otros compuestos del sistema inmunológico que pueden ayudar a matar el antígeno o movilizar el sistema inmunológico de otras formas. Un conjunto de estos, por ejemplo, desencadena la cascada del complemento, dijo Greene. .
"El complemento es en realidad el verdugo", que perfora agujeros en la célula objetivo, como la membrana de un virus, dijo Greene..
Los anticuerpos, que también se denominan inmunoglobulinas (Ig), tienen todos la misma forma de Y básica, pero hay cinco variaciones sobre este tema, llamadas IgG, IgM, IgA, IgD e IgE, dijo Jason Cyster, profesor de microbiología e inmunología. en la Universidad de California, San Francisco.
Cada variación se ve ligeramente diferente y desempeña funciones ligeramente diferentes en el sistema inmunológico. Por ejemplo, la inmunoglobulina G, o IgG, es solo una Y, mientras que la IgM se parece un poco a la diosa hindú Durga de 10 brazos, con cinco Y juntas, y cada diente puede unir un antígeno..
IgG e IgM son los anticuerpos que circulan en el torrente sanguíneo y entran en órganos sólidos, dijo Cyster. La IgA se "expulsa del cuerpo a chorros", en moco o secreciones, dijo Cyster. La IgE es el anticuerpo que generalmente desencadena respuestas alérgicas, como al polen o al maní, según la Academia Estadounidense de Alergia, Asma e Inmunología. La IgD ha sido históricamente enigmática, pero una de sus funciones es ayudar a activar las células que producen anticuerpos..
Relacionado: Fiebre del heno y alergias estacionales: síntomas, causas y tratamiento
¿Dónde se forman los anticuerpos??
Para comprender los anticuerpos, primero debe conocer las células B, que son un tipo de glóbulo blanco que se forma en la médula ósea. Hay alrededor de un billón de células B en el cuerpo, y cada una tiene un anticuerpo IgM único que se encuentra en la superficie de la célula B y cada uno se une a un antígeno, dijo Simon Goodman, Gerente del Programa de Ciencia y Tecnología de The Antibody Society. , una organización sin fines de lucro que representa a quienes participan en la investigación y el desarrollo de anticuerpos.
Este asombroso nivel de variación permite que el cuerpo reconozca casi cualquier sustancia que pueda entrar. Así es como logra esa diversidad: en cada célula B, los genes que codifican el sitio de unión del anticuerpo se mezclan como si fueran cartas en una baraja..
"La cantidad de reordenamiento que puede ocurrir es enorme", dijo Cyster. .
Relacionado: 11 hechos sorprendentes sobre el sistema inmunológico
Estas células B luego patrullan el cuerpo, a menudo permaneciendo más tiempo en áreas como los ganglios linfáticos o las amígdalas, dijo Cyster. La mayoría de las veces, estas células B no se unen a nada. Pero si, por una probabilidad entre un millón, una célula B se une a una sustancia extraña, "eso hace que la célula B diga 'Oye, tenemos que activarnos'", dijo Cyster..
La célula B crece de tamaño y comienza a dividirse en lo que se llama "expansión clonal", dijo Cyster..
"Es una copia idéntica del padre, al igual que la madre", dijo Cyster. Después de aproximadamente una semana, puede haber cientos de miles o un millón de estas copias..
Finalmente, estas células B expandidas clonalmente se diferencian en células plasmáticas, que son fábricas de anticuerpos..
"Secretan 10.000 anticuerpos por célula por segundo. Pueden hacerlo durante semanas o años si tienes suerte", dijo Cyster..
Pero no todas las células B se dividen en la misma cantidad.
"Si considera que la celda B es una cerradura, y considera que todas estas cosas diferentes flotan como llaves diferentes, algunas de las llaves encajarán mejor, otras encajarán peor y otras no encajarán en absoluto ", dijo Goodman. "Y dependiendo de qué tan bien encaje la llave en la cerradura de la superficie de una celda B en particular, esa celda se activará para dividirse más". Luego, las células B más prolíficas producen más células plasmáticas y producen más de un tipo específico de anticuerpo..
El cuerpo tampoco produce un solo tipo de anticuerpo; produce un zoológico desordenado y caótico de ellos. Cada uno se fija en diferentes partes de un invasor..
Y no todos los anticuerpos hacen lo mismo una vez que se han unido a un objetivo. Algunos cortan la infección de raíz neutralizando directamente una amenaza, evitando que un patógeno entre en una célula. Otros etiquetan a los invasores, para que las células asesinas del sistema inmunológico (que no son anticuerpos) puedan eliminarlo, dijo Greene. Otros pueden envolver virus o bacterias en una capa pegajosa. Y otros anticuerpos podrían decirle a las células inmunes parecidas a Pac-Man llamadas macrófagos que vengan a devorar al invasor. (Esa estrategia a veces puede ser contraproducente con los virus, que pueden cooptar esta respuesta para invadir nuevas células, agregó Cyster).
El primer tipo de anticuerpo que se forma después de estar expuesto a un virus es el IgM, que surge dentro de los 7 a 10 días posteriores a la exposición, dijo Greene. La IgM puede unirse a un invasor, pero cada "Y" en esta proteína de 10 brazos lo hace bastante débilmente. Pero, así como cinco personas débiles que trabajan juntas pueden enfrentarse a un adversario grande y fuerte, las cinco Y (10 brazos) de IgM que trabajan juntas pueden unirse estrechamente a un antígeno, agregó..
Aproximadamente a los 10 a 14 días, el cuerpo comienza a producir IgG, que es el "principal caballo de batalla" del sistema inmunológico, dijo Greene. La IgG puede atravesar la placenta en una mujer embarazada, lo que le da al recién nacido protección pasiva contra la enfermedad hasta que su propio sistema inmunológico pueda aumentar, agregó Greene..
Normalmente, el sistema inmunológico es increíblemente bueno para reconocer al enemigo e ignorar o tolerar nuestras propias células. A veces, sin embargo, este proceso sale mal. Ahí es cuando entran las células T (otro tipo de glóbulos blancos). El cuerpo usa estas células T para verificar los objetivos, solo si tanto una célula B como una célula T reconocen algo como un invasor extraño se activará la respuesta, dijo Goodman. Se supone que el cuerpo elimina las células B que producen los llamados autoanticuerpos, que reaccionan con las propias células del cuerpo. Pero cuando eso no sucede, el cuerpo puede marcar sus propias células para su destrucción y luego eliminarlas sin descanso. Pueden resultar enfermedades autoinmunes como el lupus, la artritis reumatoide o la diabetes tipo 1, dijo Goodman. Hay más de 100 trastornos autoinmunes, según la Asociación Estadounidense de Enfermedades Autoinmunes Relacionadas.
¿Qué son los anticuerpos monoclonales??
Los anticuerpos se han convertido en la base de algunos de los medicamentos más útiles, así como de algunas de las técnicas de laboratorio más poderosas en biología, dijo Goodman. Una de estas superestrellas clínicas y terapéuticas es lo que se conoce como anticuerpo monoclonal..
Para crear un anticuerpo monoclonal, los investigadores vacunan a un animal (o posiblemente a un ser humano) para estimular la producción de anticuerpos contra una sustancia en particular. El cuerpo producirá gradualmente anticuerpos que son cada vez más efectivos contra ese antígeno. Estas células productoras de anticuerpos luego se filtran de los glóbulos blancos y se colocan en un plato para ver qué células se unen mejor al antígeno, dijo Goodman. Luego se aísla la célula que se une mejor: es una fábrica productora de anticuerpos, específicamente perfeccionada para producir un anticuerpo súper selectivo.
A partir de ahí, esa célula se fusiona con una célula cancerosa de la sangre, produciendo algo llamado hibridoma. Este hibridoma, o monoclón, es un generador inagotable de exactamente el mismo anticuerpo, una y otra vez. (Los investigadores unen la célula monoclonal a una célula cancerosa porque el cáncer simplemente continúa reproduciéndose).
"Simplemente produce y produce y produce, y nunca se detendrá, y es un cáncer, por lo que es esencialmente inmortal", dijo Goodman. Lo que produce es un anticuerpo monoclonal..
Relacionado: La sangre de un sobreviviente del ébola podría conducir a una futura vacuna
Estas líneas celulares tienen una gama de usos increíblemente diversa. Hay millones de anticuerpos monoclonales comerciales, que se utilizan en laboratorios para etiquetar los objetivos celulares más pequeños y específicos para su estudio, dijo Goodman..
"Son increíbles, son herramientas increíblemente precisas", dijo Goodman..
Los anticuerpos monoclonales también forman la base de muchos fármacos de gran éxito. Por ejemplo, el medicamento adalimumab (nombre comercial Humira), es un anticuerpo monoclonal que trata la artritis reumatoide inhibiendo una proteína inflamatoria conocida como citocina. Otro, llamado bevacizumab (Avastin), se dirige a una molécula que estimula el crecimiento de los vasos sanguíneos; al bloquear esta molécula, bevacizumab puede retardar el crecimiento de los cánceres de pulmón, colon, riñón y algunos cánceres de cerebro.
Y en la pandemia de SARS-CoV-2, los médicos de todo el mundo están compitiendo para crear anticuerpos monoclonales que, con suerte, neutralizarán el nuevo coronavirus, dijo Greene. Estos anticuerpos se filtran del plasma de personas que se han recuperado de COVID-19 (también llamado suero convaleciente). La esperanza es que al aislar los anticuerpos más efectivos y luego producirlos en masa, los médicos puedan crear un tratamiento que proporcione una inmunidad "pasiva" temporal hasta que el cuerpo pueda ponerse al día y montar una respuesta efectiva y más duradera en propia, dijo Greene.
Relacionado: 1 de cada 5 personas examinadas en Nueva York tiene anticuerpos contra el coronavirus
Por el contrario, los anticuerpos policlonales se derivan de múltiples células B. Los anticuerpos policlonales son una biblioteca de anticuerpos que se unen todos a partes ligeramente diferentes del antígeno o diana. Los anticuerpos policlonales se producen típicamente inyectando a un animal con el antígeno, estimulando una respuesta inmune y luego extrayendo el plasma de los animales para producir anticuerpos en masa, según un estudio de 2005 en la revista Institute for Laboratory Animal Research (ILAR)..
A diferencia de los anticuerpos monoclonales, que pueden tardar hasta 6 meses en producirse, los anticuerpos policlonales se pueden producir en 4 a 8 semanas y requieren menos experiencia técnica. Además, para ciertos tipos de pruebas en las que intenta detectar el antígeno, los anticuerpos policlonales pueden tener una mayor probabilidad de unirse al antígeno diana, lo que los hace potencialmente más sensibles. La desventaja de los anticuerpos policlonales es que, debido a que cada animal individual puede producir una matriz diferente de anticuerpos, hacer anticuerpos policlonales que sean consistentes de un lote a otro puede ser más desafiante, y no es tan fácil tener un gran suministro, según un estudio de 2005 en la revista Biotechniques.
¿Cómo funcionan las pruebas de anticuerpos??
Las pruebas de anticuerpos detectan si el cuerpo ha producido cantidades detectables de anticuerpos contra una determinada molécula y, por lo tanto, pueden revelar si alguien ha sido infectado por un virus o una bacteria específicos en el pasado. Por lo general, estas pruebas detectan IgM o IgG, informadas previamente.
Por ejemplo, las pruebas de anticuerpos del SARS-CoV-2 generalmente detectan parte o la totalidad de la proteína de pico del coronavirus y pueden revelar si alguien ha tenido COVID-19 en el pasado. Debido a que el cuerpo necesita tiempo para aumentar su producción de anticuerpos, las personas generalmente solo dan positivo unas dos semanas después de haber estado expuestas por primera vez al patógeno, según se informó anteriormente..
Relacionado: ¿Pueden las pruebas de anticuerpos indicar si es inmune al COVID-19??
Hay dos tipos comunes de pruebas de anticuerpos: pruebas de flujo lateral y pruebas de ensayo de inmunoabsorción ligado a enzimas (ELISA). Ambos implican fijar un antígeno a una superficie y luego detectar si un anticuerpo se une a ese antígeno. Por lo general, una reacción química, como la fluorescencia o un cambio de color, se desencadena cuando el anticuerpo se une al antígeno. Los ensayos de flujo lateral son similares a las pruebas de embarazo de pipí en una varilla; en lugar de orinar, para las pruebas de anticuerpos, se lava sangre o suero sobre la superficie plana, que suele ser papel. Las pruebas ELISA funcionan con un principio similar, solo las pruebas se realizan en microplacas y requieren un técnico de laboratorio, y es posible que los resultados no se lean al instante, Charlotte Sværke Jørgensen, quien estudia Serología de Diagnóstico Especial Microbiológico y de Virus en el Statens Serum Institut en Copenhague, previamente dicho en un correo electrónico.
Una buena prueba de anticuerpos es aquella que produce pocos falsos positivos y pocos falsos negativos, como se informó anteriormente. Para asegurarse de que eso suceda, los científicos deben "calibrar" su prueba, por ejemplo, asegurándose de que las muestras que se sabe que no tienen el antígeno no produzcan falsamente una prueba positiva. Por ejemplo, con SARs-CoV-2, eso significaría analizar muestras de sangre antes de que comenzara la pandemia y asegurarse de que ninguna muestra dé positivo. También deben tomar muestras que definitivamente contengan el anticuerpo y asegurarse de que la prueba de anticuerpos haga un buen trabajo al detectar esos positivos..
Recursos adicionales:
- Vea un video sobre cómo funcionan los anticuerpos, producido por el Proyecto Vaccine Makers.
- Obtenga más información sobre las pruebas de anticuerpos de los Centros para el Control y la Prevención de Enfermedades.
- Lea lo que el director de los Institutos Nacionales de Salud, Dr. Francis Collins, tiene que decir sobre los anticuerpos contra el SARS-CoV-2, según se publicó en el blog del director de los NIH el 30 de junio de 2020.















