
Yurii Mongol
0
3080
815
Los científicos pueden finalmente comprender la misteriosa transición detrás de un experimento de química centenario. Los detalles de esta transformación, en la que agregar electrones a una solución de amoníaco azul brillante la transforma en un bronce metálico brillante, han eludido durante mucho tiempo a los científicos..
El nuevo estudio revela los detalles sutiles de este cambio y muestra que esta transformación es gradual, en lugar de repentina. "Lo que hemos hecho con éxito es que hemos entendido bastante bien cómo se comportan estas soluciones en una amplia gama de concentraciones utilizando una técnica de microjet", dijo el coautor del estudio Ryan McMullen, estudiante de doctorado en química de la Universidad del Sur de California. . Esta técnica, que consiste en disparar chorros finos como un cabello de la solución a través de un vacío, no se ha utilizado antes en el líquido brillante..
Y el descubrimiento podría abrir nuevos tipos de reacciones en la química orgánica en el futuro, dijo McMullen. .
Relacionado: 8 elementos químicos de los que nunca has oído hablar
Que es un metal?
Los metales son un grupo diverso. Algunos, como el litio, son lo suficientemente livianos para flotar, mientras que otros, como el plomo o el osmio, son extremadamente densos. Algunos requieren temperaturas increíblemente altas para derretirse, mientras que otros se derriten fácilmente (Mercurio, por ejemplo, se derrite a menos 38,3 grados Celsius, o menos 37,9 grados Fahrenheit). En última instancia, lo que los metales tienen en común es su capacidad para conducir electricidad en el cero absoluto, el punto en el que el movimiento molecular del calor se detiene esencialmente..
Pero, ¿cómo se transforman algunos no metales en metales? En un nuevo estudio, los investigadores respondieron esa pregunta agregando metales al amoníaco líquido..
Primero, los investigadores condensaron amoníaco, que es un gas a temperatura ambiente, en un líquido enfriándolo a 27.4 F negativos (menos 33 C). Luego agregaron sodio, litio o potasio, que son todos metales alcalinos. (Más bien famoso, estos metales reaccionan explosivamente cuando se sumergen en agua). Los experimentos se realizaron en colaboración con científicos de la Academia Checa de Ciencias y el Instituto Fritz-Haber de la Sociedad Max Planck en Berlín, así como con investigadores en Japón y Francia..
Relacionado: Las 10 explosiones más grandes de la historia
El resultado fue una reacción esperada: el amoníaco líquido extrajo electrones del metal. Luego, esos electrones quedaron atrapados entre las moléculas de amoníaco, creando los llamados electrones solvatados que los investigadores esperaban estudiar. A bajas concentraciones, el resultado fue un líquido azul no metálico. Sin embargo, a medida que los electrones solvatados o atrapados se acumulaban, la solución pasó a ser de bronce brillante..
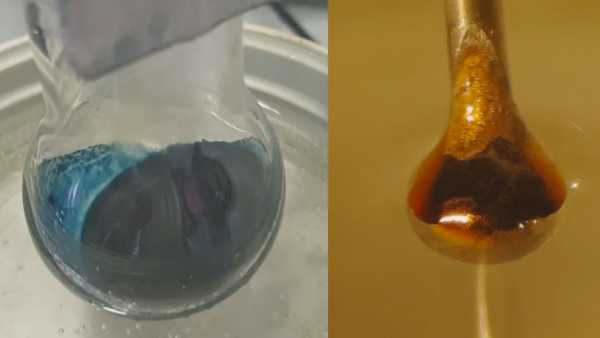
El siguiente desafío fue investigar cómo se comportaban los electrones solvatados a diferentes concentraciones. Esto implicó disparar un microjet de la solución, aproximadamente del ancho de un cabello humano, a través de un haz de rayos X de sincrotrón, que son rayos X de alta energía. Los rayos X excitaron los electrones solvatados, haciendo que salieran de su jaula líquida de moléculas de amoníaco. Luego, los investigadores pudieron medir cuánta energía se necesitó para liberar los electrones solvatados..
Los investigadores encontraron que cuanto mayor es la concentración de electrones solvatados, más coincide el patrón de liberación de energía con lo que se ve en un metal. Esto es lo que eso significa: si grafica la cantidad de energía requerida para liberar electrones de su jaula de amoníaco líquido, los metales generalmente tienen lo que se llama un "borde Fermi", una transición muy abrupta, dijo McMullen. A concentraciones más bajas de electrones solvatados, este gráfico de liberación de energía se parece más a una colina redondeada. Solo a concentraciones más altas de electrones emergió este borde de Fermi. El borde refleja cuánta energía tienen los electrones a una temperatura determinada, agregó McMullen..
"Cuando aumenta la concentración en el rango metálico, entonces ve, emerge este patrón maravilloso que es muy, muy característico de un metal", dijo McMullen..
Los resultados fueron interesantes porque mostraron que el líquido similar a un metal creado al combinar metales alcalinos y amoníaco en realidad es un metal en un nivel físico fundamental, dijo..
"Es un metal genuino, no es algo que simplemente se parece a uno", dijo McMullen..
Los electrones solvatados de menor concentración se utilizan en un tipo de reacción llamada reacción de Birch, que agrega electrones a estructuras moleculares llamadas anillos aromáticos. Este tipo de reacción se utilizó en la fabricación de las primeras píldoras anticonceptivas orales en la década de 1950, dijo McMullen. Al comprender cómo funcionan los electrones solvatados a altas concentraciones, los investigadores pueden encontrar potencialmente nuevos tipos de reacciones químicas, dijo. Por ejemplo, podrían excitar los electrones solvatados con haces de luz para que se comporten de nuevas formas..
"Si haces cosquillas a los electrones un poco para que estén más energéticamente excitados, puedes comenzar a ver algunas reacciones locas que de otra manera nunca ocurrirían", dijo McMullen..
Los investigadores publicaron sus hallazgos el 5 de junio en la revista Science..
Ver todos los comentarios (2)














